Oleh
pak-dibyo
Tabel Periodik
Tabel periodik ialah tampilan unsur-unsur kimia dalam bentuk tabel. Unsur-unsur tersebut disusun berdasarkan nomor atom atau jumlah proton dalam inti atom, konfigurasi elektron, dan keberulangan sifat kimia.
Tabel terbagi menjadi empat blok :
- Blok -s
- Blok -p
- Blok -d
- Blok -f
Keterangan :
- Secara umum, pada satu periode (baris), di sebelah kiri bersifat logam, dan di sebelah kanan bersifat non-logam.
- Baris pada tabel tersebut disebut periode, sedangkan kolom disebut golongan.
Tabel Periodik Modern :
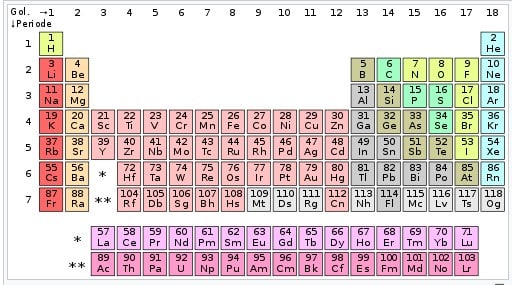
Contoh : Unsur golongan 17 yaitu halogen dan golongan 18 ialah gas mulia. Tabel periodik bisa dipakai untuk menurunkan hubungan antara sifat-sifat unsur, dan memperkirakan sifat unsur baru yang belum ditemukan. Tabel periodik memberikan kerangka kerja untuk melakukan analisis pada perilaku kimia, dan banyak dipakai pada bidang kimia dan ilmu lainnya.
Metode Pengelompokan
Pada metode pengelompokan terbagi menjadi empat kelompok, yaitu
- Golongan
- Periode
- Blok
- Logam, Metaloid dan Nonlogam
1. Golongan
Golongan atau famili ialah kolom vertikal pada tabel periodik. Golongan biasanya memiliki tren periodik yang lebih bermakna daripada golongan periode dan blok, yang akan dijelaskan kemudian. Teori mekanika kuantum modern dari struktur atom menjelaskan tentang unsur-unsur yang berada pada golongan yang sama mempunyai konfigurasi elektron yang sama pada kulit valensinya.
Akibatnya, unsur-unsur pada golongan yang sama cenderung mempunyai sifat serta tren yang jelas sejalan dengan kenaikan nomor atom. Akan tetapi, dalam beberapa bagian tabel periodik, seperti blok-d dan blok-f, kesamaan horisontal itu lebih penting, ataupun lebih jelas daripada kesamaan vertikalnya
Contoh golongan tabel periodik
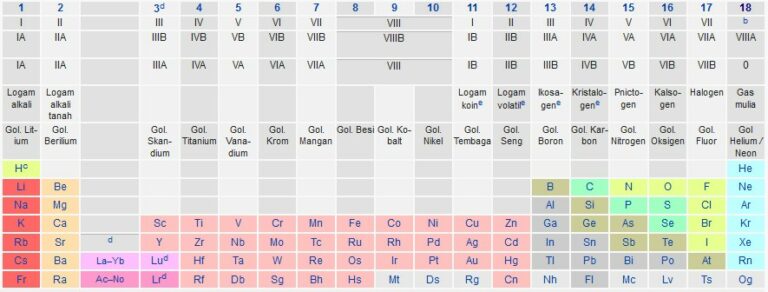
2. Periode
Periode ialah baris horizontal pada tabel periodik. Walaupun golongan lebih pada menggambarkan tren periodik, Akan tetapi ada beberapa bagian di mana tren horizontal lebih signifikan daripada tren vertikal. Misalnya pada blok-f, di mana lantanida dan aktinida membentuk dua seri unsur horizontal yang substansial
Contoh periode tabel periodik
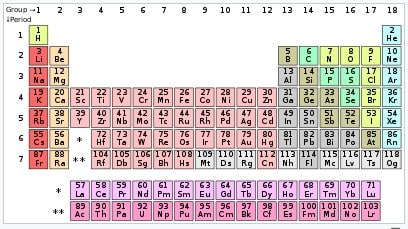
Unsur-unsur pada periode yang sama menunjukkan tren energi ionisasi, jari-jari atom, afinitas elektron, dan elektronegativitas. Dari kiri ke kanan pada periode yang sama, jari-jari atombiasanya menyusut.
Hal ini terjadi dikarenakan masing-masing unsur yang berurutan menambah proton maupun elektron, yang menyebabkan elektron tertarik lebih dekat pada inti atom. Penurunan jari-jari atom ini yang menyebabkan energi ionisasi meningkat dari kiri ke kanan pada satu periode.
Semakin kuat ikatan suatu unsur, maka semakin banyak energi yang di butuhkan untuk melepas elektron.Elektronegativitas meningkat sesuai dengan kenaikan energi ionisasi dikarenakan elektron tertarik ke inti atom.
Afinitas elektron juga menunjukkan bahwa kecenderungan serupa pada periode yang sama. Logam (periode sebelah kiri) umumnya memiliki afinitas elektron yang lebih rendah daripada non logam (periode sebelah kanan), dengan pengecualian pada gas mulia
3. Blok
Bagian tertentu pada tabel periodik bisa dirujuk sebagai blok sesuai dengan urutan pengisian kulit elektron unsur-unsurnya. Masing-masing blok diberi nama yang sesuai dengan sub kulit tempat elektron terakhir berada
Contoh blok tabel periodik
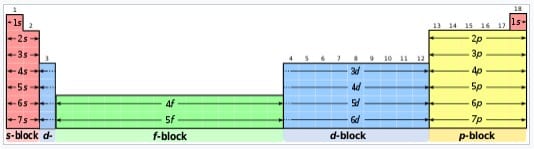
- Blok-s terdiri dari dua golongan pertama yaitu logam alkali dan alkalil tanah ditambah hidrogen dan helium.
- Blok-p terdiri atas enam golongan terakhir, yaitu golongan 13 hingga 18 sesuai dengan IUPAC (3A hingga 8A sesuai penamaan Amerika), dan mengandung, sebagian besar metaloid. Blok-d terdiri atas golongan 3 hingga 12 (atau golongan 3B sampai 2B dalam penggolongan sistem Amerika) dan seluruhnya yaitu berupa logam transisi.
- Blok-f, seringnya diletakkan di bawah tabel utama, tidak mempunyai nomor golongan dan terdiri atas lantanida dan aktinida.
4. Logam, Metaloid, dan Nonlogam
Sesuai dengan sifat fisika dan kimianya, unsur bisa diklasifikasikan ke dalam tiga kategori besar yaitu logam, metaloid dan nonlogam
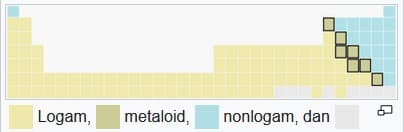
Logam umumnya berkilau, padatan konduktivitas tinggi, bisa membentuk aloy dengan logam lainnya dan membentuk senyawa ion serupa garam dengan nonlogam atau selain gas mulia. Sebagian besar nonlogam yaitu berupa gas berwarna ataupun tak berwarna.
Nonlogam yang membentuk senyawa dengan nonlogam yang lainnya berikatan secara kovalen. Di antara logam dan nonlogam ada metaloid, yang memiliki sifat di antara logam dan nonlogam ataupun campuran keduanya
Logam dan nonlogam bisa diklasifikasikan lebih lanjut dalam subkategori yang menunjukkan gradasi sifat dari logam ke nonlogam, untuk unsur-unsur pada periode yang sama. Logam terbagi ke dalam logam alkali yang reaktif, lantanida dan aktinida, logam alkali tanah yang kurang reaktif, logam transisi, dan terakhir logam pasca-transisi dengan sifat fisika dan kimia paling lemah.
Nonlogam dibagi menjadi nonlogam poliatomik, yang lebih mirip dengan metaloid; nonlogam diatomik, yang merupakan nonlogam esensial dan gas mulia monoatomik, yang merupakan nonlogam dan hampir inert sempurna. Penggolongan terspesialisasi logam refraktori dan logam mulia, yang merupakan logam transisi, juga diketahui dan terkadang dicantumkan.
Tabel Periodik Unsur Kimia
Di bawah ini akan di tampilkan gambar tabel periodik unsur kimia lengkap yang meliputi nama-nama unsur, simbol beserta keterangannya
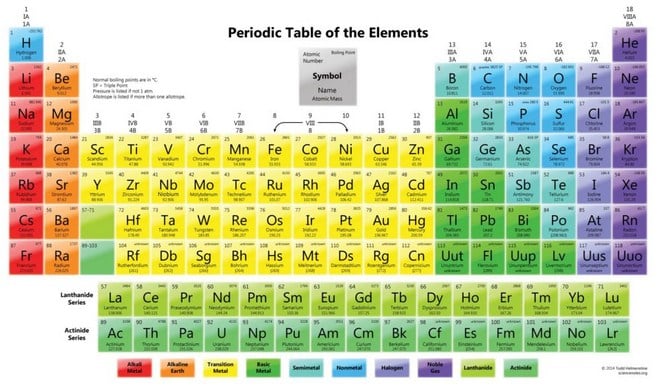
Keterangan:
| No atom | Unsur Kimia | Simbol |
| 1 | hidrogen | H |
| 2 | helium | He |
| 3 | lithium | Li |
| 4 | beryllium | Be |
| 5 | boron | B |
| 6 | carbon | C |
| 7 | nitrogen | N |
| 8 | oxygen | O |
| 9 | fluorine | F |
| 10 | neon | Ne |
| 11 | sodium | Na |
| 12 | magnesium | Mg |
| 13 | aluminum | Al |
| 14 | silicon | Si |
| 15 | phosphorus | P |
| 16 | sulfur | S |
| 17 | chlorine | Cl |
| 18 | argon | Ar |
| 19 | potassium | K |
| 20 | calcium | Ca |
| 21 | scandium | Sc |
| 22 | titanium | Ti |
| 23 | vanadium | V |
| 24 | chromium | Cr |
| 25 | manganese | Mn |
| 26 | iron | Fe |
| 27 | cobalt | Co |
| 28 | nickel | Ni |
| 29 | copper | Cu |
| 30 | zinc | Zn |
| 31 | gallium | Ga |
| 32 | germanium | Ge |
| 33 | arsenic | As |
| 34 | selenium | Se |
| 35 | bromine | Br |
| 36 | krypton | Kr |
| 37 | rubidium | Rb |
| 38 | strontium | Sr |
| 39 | yttrium | Y |
| 40 | zirconium | Zr |
| 41 | niobium | Nb |
| 42 | molybdenum | Mo |
| 43 | technetium | Tc |
| 44 | ruthenium | Ru |
| 45 | rhodium | Rh |
| 46 | palladium | Pd |
| 47 | silver | Ag |
| 48 | cadmium | Cd |
| 49 | indium | In |
| 50 | tin | Sn |
| 51 | antimony | Sb |
| 52 | tellurium | Te |
| 53 | iodine | I |
| 54 | xenon | Xe |
| 55 | cesium | Cs |
| 56 | barium | Ba |
| 57 | lanthanum | La |
| 58 | cerium | Ce |
| 59 | praseodymium | Pr |
| 60 | neodymium | Nd |
| 61 | promethium | Pm |
| 62 | samarium | Sm |
| 63 | europium | Eu |
| 64 | gadolinium | Gd |
| 65 | terbium | Tb |
| 66 | dysprosium | Dy |
| 67 | holmium | Ho |
| 68 | erbium | Er |
| 69 | thulium | Tm |
| 70 | ytterbium | Yb |
| 71 | lutetium | Lu |
| 72 | hafnium | Hf |
| 73 | tantalum | Ta |
| 74 | tungsten | W |
| 75 | rhenium | Re |
| 76 | osmium | Os |
| 77 | iridium | Ir |
| 78 | platinum | Pt |
| 79 | gold | Au |
| 80 | mercury | Hg |
| 81 | thallium | Tl |
| 82 | lead | Pb |
| 83 | bismuth | Bi |
| 84 | polonium | Po |
| 85 | astatine | At |
| 86 | radon | Rn |
| 87 | francium | Fr |
| 88 | radium | Ra |
| 89 | actinium | Ac |
| 90 | thorium | Th |
| 91 | protactinium | Pa |
| 92 | uranium | U |
| 93 | neptunium | Np |
| 94 | plutonium | Pu |
| 95 | americium | Am |
| 96 | curium | Cm |
| 97 | berkelium | Bk |
| 98 | californium | Cf |
| 99 | einsteinium | Es |
| 100 | fermium | Fm |
| 101 | mendelevium | Md |
| 102 | nobelium | No |
| 103 | lawrencium | Lr |
| 104 | rutherfordium | Rf |
| 105 | dubnium | Db |
| 106 | seaborgium | Sg |
| 107 | Bohrium | Bh |
| 108 | Hassium | Hs |
| 109 | meitnerium | Mt |
| 110 | Darmstadtium | Ds |
| 111 | Roentgenium | Rg |
| 112 | Copernicium | Cn |
| 113 | Ununtrium | Uut |
| 114 | Ununquadium | Uuq |
| 115 | Ununpentium | Uup |
| 116 | Ununhexium | Uuh |
| 117 | Ununseptium | Uus |
| 118 | Ununoctium | Uuo |
Demikianlah penjelasan Rumusrumus.com tentang tabel sistem periodik unsur kimia beserta keterangan dan gambar hd nya, Semoga bermanfaat…
- Dapatkan link
- X
- Aplikasi Lainnya
- Dapatkan link
- X
- Aplikasi Lainnya
Komentar
Posting Komentar